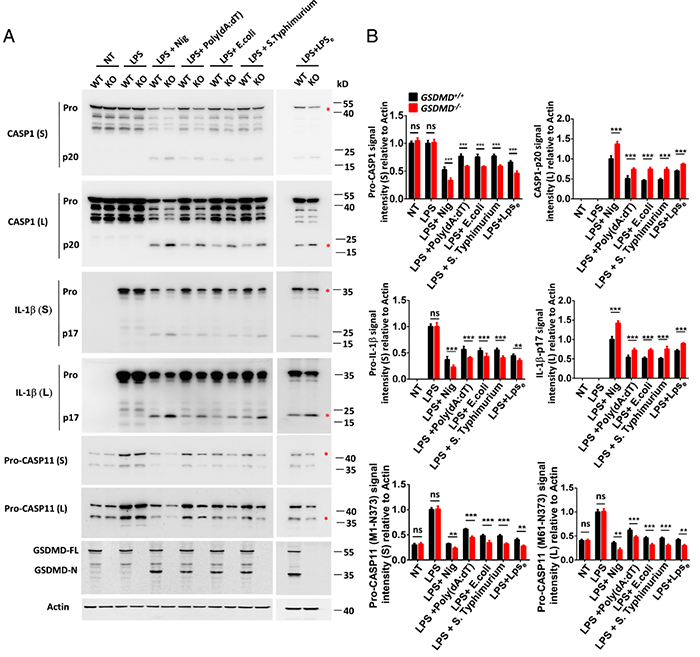
炎症途径通常利用负反馈调节系统来防止过度炎症反应引起的组织损伤。这种负反馈机制是否存在于炎症小体的激活中尚不清楚。
2022年11月2日,南京医科大学杨硕,南京中医药大学胡刚及王冰微共同通讯在PNAS 上在线发表题为“The Gasdermin D N-terminal fragment acts as a negative feedback system to inhibit inflammasome-mediated activation of Caspase-1/11”的研究论文,该研究发现 Gasdermin D (GSDMD) 被caspase-1/11裂解后,利用其位于N端β1-β2环的RFWK基序以负反馈方式抑制caspase-1/11的激活和下游的炎症反应。
基于RFWK基序的肽抑制剂可以抑制caspase-1/11的活化及其下游底物GSDMD和白细胞介素-1β的裂解,以及脂多糖诱导的小鼠脓毒症。综上所述,这些发现证明了GSDMD的N末端片段可作为负反馈调节因子控制炎症小体的激活,并进一步设计了一个基于RFWK基序的分子,该分子显示出强大的抗炎作用。

炎症是一把双刃剑。在应对感染或组织损伤时,对机体发挥有益作用,确保侵袭性病原体的清除,促进受损组织的修复。然而,过度和持续的炎症会导致组织的病理损伤和多种炎症性疾病,包括脓毒症、糖尿病、心血管疾病、炎症性肠病和神经退行性疾病。因此,炎症反应需要受到严格控制并及时化解。机体免疫系统已经进化出多种负反馈调节机制来精确控制炎症反应:例如IkBα抑制NF-κB炎症通路,A20抑制TRAF6信号通路,IRAK-M抑制toll样受体(TLR)信号通路,SOCS3抑制JAK2/STAT3信号通路,MSK抑制MAPK信号通路。这些研究都强调了负反馈调节在控制炎症中的重要作用。炎症小体是由病原体相关分子模式和宿主衍生的危险相关分子模式触发的信号平台,导致髓系细胞炎症反应的启动。在识别刺激信号后,炎症小体的核心蛋白(如NLRS, AIM2和Pyrin)与凋亡相关斑点样蛋白和促炎半胱氨酸天冬氨酸蛋白酶(caspase-1和-11)组装成胞质多蛋白复合物,导致caspase自激活,然后将白细胞介素-1β (IL-1β)和IL-18前体加工成其成熟形式。此外,炎症性半胱氨酸天冬氨酸蛋白酶在其中心连接结构域切割Gasdermin D (GSDMD),从而诱导促炎症形式的程序性细胞死亡,称为细胞焦亡。炎症小体活化失调与多种人类炎症性疾病有关,如2型糖尿病、动脉粥样硬化、痛风、多发性硬化(MS)和脓毒症。此外,NLRP3基因的功能获得性突变会导致自身炎症性疾病,包括家族性寒冷自身炎症综合征(FCAS)和Muckle-Wells综合征(MWS)。研究表明,一氧化氮(NO)对NLRP3的s-亚硝基化、PKA对NLRP3的磷酸化和自噬清除炎症小体等方式都可抑制炎症小体的过度激活,但炎症小体激活中的自我调节负反馈机制仍有待完全阐明。GSDMD缺乏会加剧炎症小体的激活(图源自PNAS )GSDMD是一种驱动细胞焦亡的成孔蛋白,位于炎症小体激活的下游,属于Gasdermin家族的成员之一。该家族还包括GSDMA、GSDMB、GSDMC、GSDME (DFNA5)和GSDMF (DFNB59)。在炎症小体激活后,来自半胱氨酸天冬氨酸蛋白酶P20/10二聚体的L2/L2 '束构建一个外泌体来识别GSDMD/ C -末端结构域(GSDMD-C)中的疏水口袋,该疏水口袋将GSDMD的结构域间连接器连接到半胱氨酸天冬氨酸蛋白酶的催化口袋中进行裂解。接下来,GSDMD的N末端结构域(GSDMD-N)从GSDMD- C结构域的自抑制作用中被切割和释放,然后通过三个相邻亚基的蛋白-蛋白界面发生构象变化和寡聚化。此外,GSDMD-N片段通过α1和α3螺旋、β1-β2环或β7-β8片与脂质结合,并转移到质膜形成寡聚化孔,诱导细胞溶解性死亡和炎症介质的释放。在该项研究中,发现GSDMD的N末端片段也可以作为促炎caspase激活的负反馈调节因子。N端片段β1-β2环的RFWK基序与caspase-1/11催化囊袋结合,抑制caspase活性。这是一种新型的调节机制,在炎症小体激活过程中负调控GSDMD-N。此外,应用RFWK基序肽抑制剂可抑制小鼠caspase-1/11的活化和脓毒症死亡,从而为开发靶向炎症小体caspase的新药提供了重要线索。https://doi.org/10.1073/pnas.2210809119